Fotografía de Maria Ionova vía Unsplash, tomada de: https://unsplash.com/photos/pbI58B0ZZt8
Ante la pandemia causada por este nuevo coronavirus SARS-CoV-2, nos han pedido mantener un estado de distanciamiento social resguardándonos en la medida de lo posible en nuestros hogares, nos han explicado consistentemente que esta acción puede ralentizar el pico máximo de contagios de la enfermedad (Covid-19) y evitar el colapso hospitalario. Estamos viendo por todo el mundo a los profesionales de la salud haciendo actos heroicos al atender a un enorme número de pacientes con escasos insumos y con medicamentos paliativos, por lo que es lógico que nos preguntemos ¿por qué para la Covid-19 no llegan los medicamentos?
No resulta fácil contestar esa pregunta ya que existen distintas razones por las que no contamos todavía con los fármacos adecuados. Lo más evidente al respecto es que, como a todos, esta infección cayó por sorpresa también en la comunidad científica y la industria farmacéutica que estaban más enfocadas en atender otras patologías, por ejemplo, las pandemias que están causando comorbilidad peligrosa con el coronavirus: entre otras, la hipertensión, el sobrepeso y la diabetes, que para el caso de la población mexicana han llegado aumentar el riesgo de letalidad para la Covid-19 casi el doble que en otros países.
Pero no sólo se debe a que los científicos no estaban orientados al diseño de medicamentos específicos para esta infección: una razón fundamental que impide la disposición de fármacos nuevos es que existe una estricta regulación internacional por la que los fármacos deben pasar antes de salir al mercado. Se podría argumentar que son tiempos excepcionales y se debe eximir a prototipos de medicamentos de estas “trabas legales” para acelerar su salida con el fin de salvar una gran cantidad de vidas; en los hechos algunas cuestiones sí se están flexibilizando y en los trámites legales se está dando prioridad a quien esté presentando propuestas de tratamiento, además de que los países están destinando una gran cantidad de recursos para apoyar este tipo de propuestas. Sin embargo, no veremos la aparición de nuevos fármacos específicos o vacunas en unos meses, por razones de seguridad.
Con este fin, cualquier sustancia que se quiera emplear como potencial medicamento tiene que seguir una serie de estudios para cumplir con requisitos estrictos (insisto en el término), para garantizar eficacia y seguridad. Ya hemos visto trágicos ejemplos por el uso inadecuado de sustancias farmacológicas en el pasado, uno de los más evidentes ha sido el uso de la talidomida, un fármaco que se sintetizó en la década de los 50´s del siglo pasado. Se autorizó su venta para el tratamiento sintomático de las náuseas y los vómitos durante el embarazo en más de 80 países, pero hasta que unos diez años después se detectó un aumento progresivo de casos de malformaciones congénitas, con una mortalidad del 40% durante el primer año de vida de los pequeños, el medicamento fue retirado en todo el mundo en 1963.
Por este tipo de riesgos, aunque a máxima celeridad, las nuevas propuestas farmacológicas para este SARS-CoV-2 tendrán que seguir el mismo protocolo que las sustancias dedicadas a combatir otras enfermedades, un proceso de desarrollo farmacéutico efectuado en varias fases.
Primero debe haber una fase preclínica en donde se analizan las características fisicoquímicas del potencial principio activo, se determina la forma farmacéutica, es decir, si será un jarabe, una cápsula, un inyectable, etcétera, y se hacen pruebas en al menos dos especies animales. A esta etapa también se le denomina fase cero y nos ayuda a determinar sí el fármaco puede tener el efecto esperado, una aproximación de la dosis y de qué tan seguro puede ser.
Con esta información se puede pasar a la fase uno, la primera en la que participan humanos como sujetos de estudio. Se emplea un pequeño grupo de voluntarios sanos (generalmente 25), que toman una sola dosis del fármaco y se monitorea la concentración del fármaco en el organismo tomando muestras periódicas de sangre; esto nos ayuda a definir adecuadamente las dosis y el tiempo de re-administración, pero más que nada nos indica qué tan seguro es el fármaco.
Posteriormente se realizan los estudios de fase dos, el medicamento se prueba en individuos enfermos (alrededor de un centenar), las pruebas determinan si el fármaco resulta efectivo y se termina por definir el intervalo de dosificación; sigue siendo un tratamiento de corta duración.
Los estudios de fase tres tienen que efectuarse en varios hospitales a la vez porque requieren de 100 a 500 pacientes, se evalúa el tratamiento prolongado para confirmar su eficacia y determinar posibles efectos adversos. Superada esta etapa, se puede solicitar el registro del medicamento y las autoridades sanitarias pueden aprobar su venta en cada país.
Estando ya en el mercado, se realizan estudios de fase cuatro, que implican la revisión de expedientes de pacientes tratados con el medicamento, vigilando en miles de pacientes la posible aparición de efectos adversos de baja frecuencia. Con estos datos las autoridades sanitarias pueden retirar el producto de ser necesario.
En cada una de estas etapas debe haber un monitoreo exhaustivo del estado de salud de los participantes, manteniendo una serie de consideraciones bioéticas para proteger su seguridad; estos estudios sólo pueden realizarse por personal capacitado y en instalaciones aprobadas por el sector salud. En condiciones “normales”, estos procesos llevan varios años y se gastan alrededor de 800 millones de dólares para obtener un nuevo fármaco.
Por todo esto, es importante subrayar la necesidad de tomar con cautela las expectativas de medios no especializados respecto a la aparición de los nuevos tratamientos contra este coronavirus. Se ha hablado sobre el uso de la Cloroquina y países como Estados Unidos, El Salvador y Brasil acapararon el producto dejando desprotegidos a pacientes con otras enfermedades como el dengue y la artritis, mientras que las primeras pruebas no están dando los resultados que esperamos.
Algo similar pudiera ocurrir con la Ivermectina: fue ampliamente difundido en los medios que este antiparasitario puede atacar al virus, pero en realidad, hasta ahora, esto sólo se ha visto en cultivos celulares y no es prudente extrapolar los resultados de estudios in vitro a la clínica, se necesita la conducción adecuada de los estudios complementarios para obtener evidencia suficiente sobre la efectividad y seguridad de los nuevos tratamientos.
Los científicos están trabajando a su máxima capacidad, hay que tenerles un poco de paciencia ya que los medicamentos que nos ayudarán a salir de esta crisis, llegarán; mientras tanto hay que darles un poco de tiempo al seguir disminuyendo la intensidad del brote, quedándonos en casa.
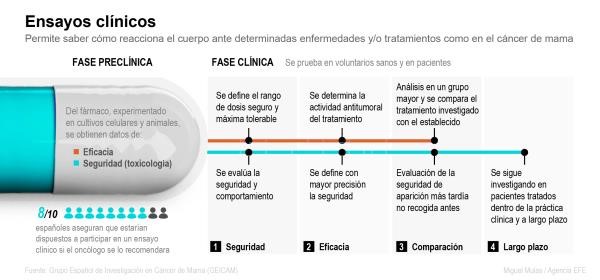
Figura 1. Ensayos Clínicos, fases del desarrollo de un nuevo medicamento. Tomado de infografías agencia efe: https://www.efe.com/efe/espana/infos/ensayos-clinicos/50000500-3781181
Más información en:
Noël F. (2020). Suggesting Treatments for COVID-19. Beware! Expectations cannot Replace Good Science. Lat Am J Clin Sci Med Technol. 2020 Apr; 2: 43.
Papaseit E, García-Algar O, Farré M. (2013). Talidomida: una historia inacabada. Anales de Pediatría;78(5): 283-287. DOI: 10.1016/j.anpedi.2012.11.022
WHO. World Health Organization. (2018). International standards for clinical trial registries: the registration of all interventional trials is a scientific, ethical and moral responsibility, version 3.0. ISBN 9789241514743 World Health Organization. https://apps.who.int/iris/handle/10665/274994.

LUIS FERNANDO ORTEGA VARELA
Facultad de Salud Pública y Enfermería
Universidad Michoacana de San Nicolás de Hidalgo

Todo proyecto tiene un plan de ejecución y es aquí donde se revisan todos los pros y contras que a un futuro inmediato puedan ser aplicados, sin dicha revisión todo se vendría abajo y lo que en su momento podría beneficiar ahora bien podría afectar y no solo eso agarbar la situación de la problemática del momento a solucionar.
Es de vital importancia conocer el proceso, el tiempo y costos del desarrollo de un nuevo fármaco para su posterior administración y venta en el mercado. Esto sin duda alguna pone sobre la mesa a discusión el tras fondo, muchas veces todo esto se deja de lado a falta de visibilidad e información; Pero que pasa, que simplemente es fácil decirlo, opinar al respecto, exigir soluciones, pero sin embargo nunca nos adentramos y la colaboración para un resultado es nula.
Todo proyecto tiene un plan de ejecución y es aquí donde se revisan todos los pros y contras que a un futuro inmediato puedan ser aplicados, sin dicha revisión todo se vendría abajo y lo que en su momento podría beneficiar ahora bien podría afectar y no solo eso agarbar la situación de la problemática del momento a solucionar.
Es muy útil conocer el largo proceso que lleva la elaboración de un medicamento, para comprender por qué es necesario esperar el tratamiento adecuado y no caer en la charlatanería y misticismo de las "fórmulas mágicas" que abundan hoy en día por la situación. Si bien no es obligación de todos memorizar por completo la concepción de los medicamentos, es de gran utilidad tener la noción de lo que se requiere, a grandes rasgos, para conseguirlos. Precisamente eso logré vislumbrar con su artículo, muchas gracias.
Saludos
LF
Gracias por bindarnos la información precisa de la serie de requisitos para garantizar la eficacia y uso de un fármaco; pues como lo estamos viviendo en la pandemia actual por el Covid19 no han encontrado aún un medicamento eficaz, aunque hay algunos fármacos prometedores como la Ivermectina; aún se sigue investigando, y mientras tanto la única forma de salir de la pandemia es con la sana distancia.
Saludos!
Report